上報 Up Media
toggle- 最新消息 【有片】債務泥淖!中國失信人數突破800萬 不到5年增加一半 2024-04-18 19:45
- 最新消息 政大命名景觀池暫居第一是「金玟池」 取自NewJeans成員本名 2024-04-18 19:21
- 最新消息 國中教育會考倒數 應考時程、考場規定一次看 2024-04-18 19:15
- 最新消息 為企業尋商機 聯輔基金會與公股行庫共同舉辦7場研討會前進台南 2024-04-18 19:00
- 最新消息 壽星酒後護花持刀殺人 法官認「酒毒辨識能力降低」輕判12年 2024-04-18 18:40
- 最新消息 【廢死論辯】「為多數人利益犧牲1個孩子」 廢死聯盟:死刑是赤裸裸的國家濫權殺人 2024-04-18 18:40
- 最新消息 2024氣候風險與生物多樣認知暨行動大調查結果出爐!近8成選擇能解決氣候問題投資商品 2024-04-18 18:38
- 最新消息 【寶林茶室中毒】3重症又嚴重感染 王必勝認:1人已需用葉克膜 2024-04-18 18:25
- 最新消息 【保母虐童致死】「姊妹」有串證之虞 法院裁定羈押禁見3月 2024-04-18 18:20
- 最新消息 【有片】 塞內加爾海軍現代化有成 第三艘新型近海巡邏艦在法國交艦 2024-04-18 18:18

中國阿茲海默症新藥九期一遭質疑療效。(圖片取自新浪)
中國上海藥物所研究員耿美玉日前率領團隊研發出阿茲海默症新藥,遭到中國科普作家方舟子質疑可信度。而耿美玉本人更被踢爆多篇論文造假,在2015到2019年間,參與的論文疑似利用裁切圖片、一圖多用等方式捏造成果。
論文審查網站PubPeer上有人指出,耿美玉有掛名的4篇論文分別發表在Oncotarget、Journal of Cancer、Cell和Hepatology。其中Cell和Hepatology論文的通訊作者為耿美玉,另外兩篇論文,耿美玉並非關鍵參與者。
多處出現裁切痕跡或一圖多用
根據網友的比對,2019的論文中有一張圖表顯示,β-Actin經過兩種不同的處理,結果卻是一模一樣。

另外,下圖紅框和藍框也是不同處理卻有疑似重疊圖片的情況。

2018的論文裡,從下方的原始圖片看來並無錯誤,但一旦將該圖片色彩反轉後,可以看到其中一條有裁剪的痕跡,如黃色箭頭所示。
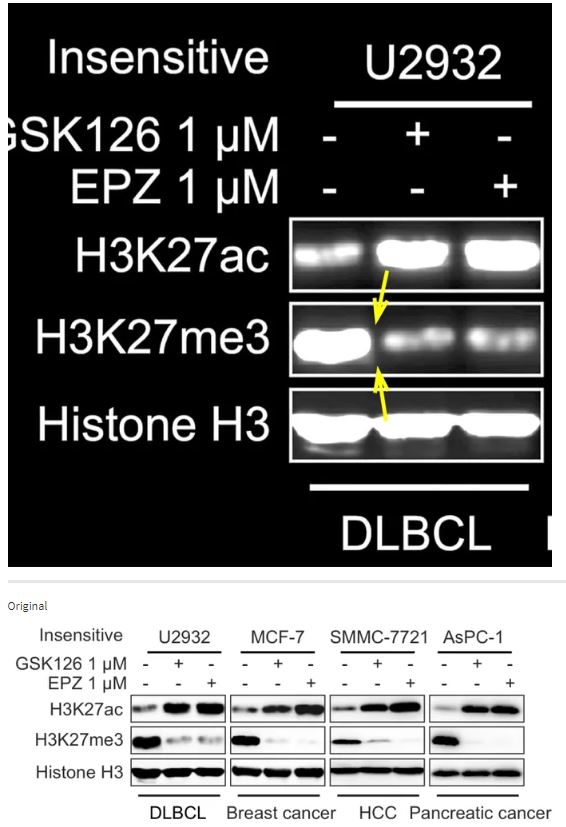
2017的論文被發現至少4處有圖片問題,包括圖像重疊、旋轉、裁切等。
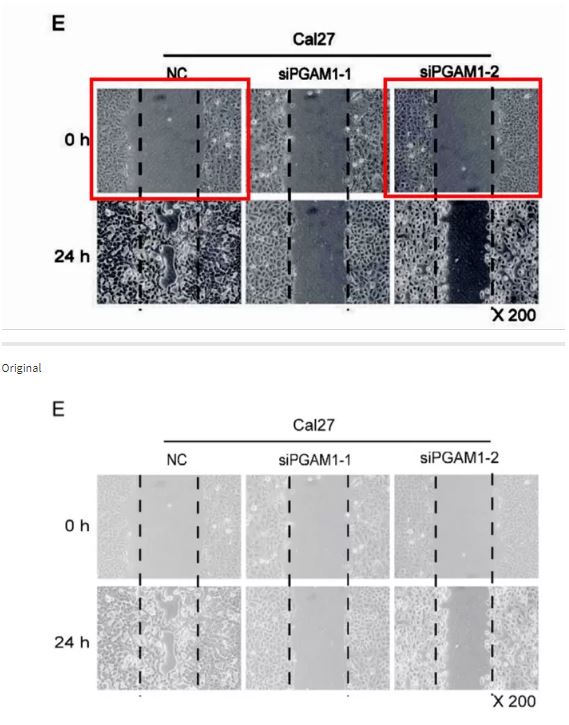
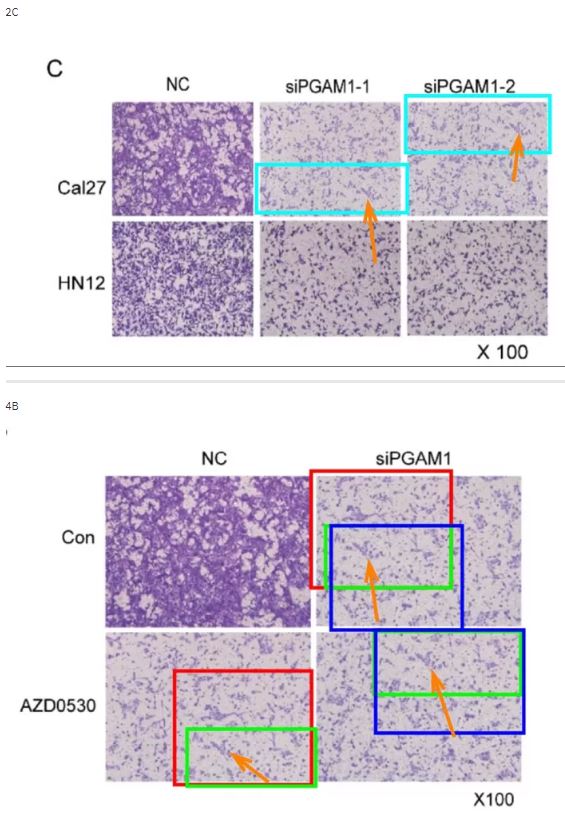
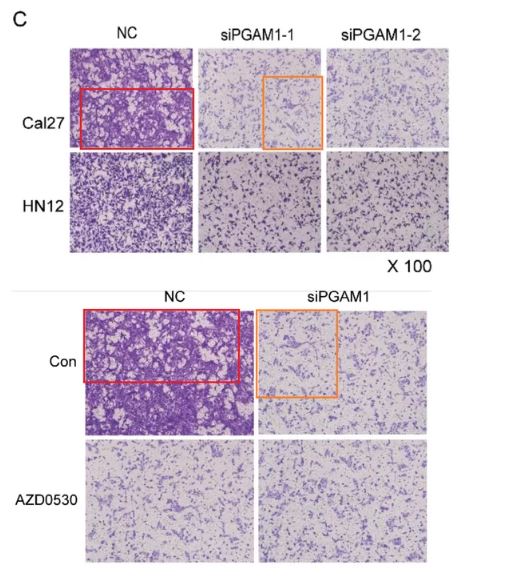
2015的論文同樣是圖片重疊問題。

除了論文被質疑造假,中國科普作家方舟子指出,跟耿美玉合作的藥廠上海綠谷靠「抗癌保健品」靈芝寶起家,但該藥物已被確認使用「虛假宣傳」手法。因此,方舟子認為號稱阿茲海默症新藥的「九期一」根本不值得一信。
實驗期短、藥效手段不明確
方舟子指出,九期一的成分是寡醣,但中國市場上有無數號稱能治療多種疾病的寡醣類保健品,為什麼偏偏只有九期一變成可以治療阿茲海默症的新藥。他提到,九期一的研發人員先是先稱藥物成分能與β類澱粉蛋白結合,抑制其在大腦皮質堆積。後來發現關於腸道菌群的研究開始流行,又有研究稱阿茲海默症可能與腸道菌群失調有關,該藥研發人員便又將藥效修改成調節腸道菌群失調,最後甚至乾脆說九期一是多靶向的,不管以後阿茲海默症被發現是什麼原因引起的,都能對其起作用。「像這樣藥理不定,連藥物發生作用的器官都不定,時而在大腦時而在大腸,跟著別人的研究『與時俱進』的新藥,也讓人難以相信。」
此外,阿茲海默症發展緩慢,試圖治療該症狀的藥物是否確實有效,應經過長期服用、觀察才能確定。國際的阿茲海默症新藥三期臨床試驗通常要讓受試者服藥長達四、五年,而九期一的三期臨床試驗卻只花了9個月即被認定具有療效。

治疗阿尔茨海默病神药的发明人上海药物所耿美玉作为负责人的论文已有六篇被发现造假数据,包括那篇证明该药药理的最新论文,也是用PS大法代替做实验。这种人搞出来的药你敢信? pic.twitter.com/HdVLAuPvZ4
— 方舟子 (@fangshimin) November 7, 2019
方舟子提到,新藥在對某種致命的急性病有很好的效果時,才會通過優先審評審批流程。但是阿茲海默症是病程進展緩慢的慢性病,「有什麼必要僅僅做了9個月的臨床試驗就通過優先審評審批流程批准上市?」國家藥監局批准時也提醒:「國家藥監局要求申請人上市後,繼續進行藥理機制方面的研究和長期安全性有效性研究,完善寡醣的分析方法,按時提交有關試驗資料。』可見國家藥監局也知道該藥沒有完成必要的研究,倉促批准其上市,讓中國患者去當其小白鼠,必然是受到了非科學因素的干擾。
最後,方舟子強調中國藥監局實際上並不具有獨立性、專業性和權威性。所以,對中國藥監局批准的「全球首次上市」藥物都不要信,尤其是這種臨床試驗連一年時間都不到、優先審評審批的藥物。理由很簡單,阿茲海默症並非中國特色病,其藥物的全球市場極其龐大,如果真的有效,就會去申請美國食品藥品管理局(FDA)的批准走向全球市場,而不會只想著只賺國內患者的錢。
既然承认可能要四五年才能观察到明显的变化,那么只做9个月的临床试验是什么意思?已上市的药只做6个月临床试验,那是20年前的事。说双盲试验不能超过9个月,否则有悖伦理,那么前面提到罗氏的药做104周双盲试验是有悖伦理了? pic.twitter.com/axYOiQhJVe
— 方舟子 (@fangshimin) November 7, 2019
熱門影音
熱門新聞
- 譚松韻新戲戀上《異人之下》侯明昊 她高馬尾造型曝光重現《錦衣之下》少女模樣
- 《淚之女王》金智媛、金秀賢互飆演技收視破20% 「洪海仁墓碑」劇照瘋傳網憂BE結局
- 《蓮花樓》成毅新劇高馬尾造型曝光帥翻 憑2關鍵奪回藝名聲勢輾壓師兄任嘉倫
- 【《承歡記》內幕曝光】楊紫片酬拿2億演技卻被罵翻 許凱演霸總9千萬輕鬆入袋
- 《與鳳行》林更新公開女友惹怒CP粉 趙麗穎親上火線17字幫忙救場超暖心
- 【韓星片酬大公開】金秀賢拍《淚之女王》因「這理由」降價演出 IU身價輾壓宋慧喬
- 【潛艦國造案】主系統裝備仰賴商購 防中國打壓埋重大變數
- 肖戰新劇凝視《惜花芷》張婧儀畫面曝光甜出汁 新片與《在暴雪時分》趙今麥演兄妹超吸睛









